基线抑制素B和抗-苗勒激素对青春期延迟 男孩低促雄性激素性腺功能减退(HH)的诊断
Re´ gis Coutant,* Estelle Biette-Demeneix,* Claire Bouvattier, Natacha Bouhours-Nouet, Fre´ de´ rique Gatelais, Sylvie Dufresne, Ste´ phanie Rouleau, and Najiba Lahlou
(* R.C.与E.B.-D.对本文有同等贡献)
Department of Pediatric Endocrinology and Center for Rare Diseases in Hormonal Receptivity (R.C., N.B.-N., F.G., S.D., S.R.), Angers University Hospital, 49033 Angers, France; Department of Pediatrics (E.B.-D.), General Hospital, 83600 Frejus, France; and Department of Pediatric Endocrinology and Center for Rare Disorders of Sex Development (C.B.), and Department of Pediatric Hormonology and Metabolic Diseases (N.L.), St. Vincent de Paul Hospital and Rene´ Descartes University, 75014 Paris, France
摘要
背景:骨龄(BA)大于生活年龄2SD,而无基础病因定义为特发性骨龄提前。因内分泌疾病而BA提前的病人,青春期也提前,并影响成年身高,所以必须进行治疗。特发性骨龄提前的自然史尚未完全确立。
目的:确定生长和青春期的形式,验证特发性BA提前儿童预测的成年身高。
方法:在1985和2008年发现的55名青春期前特发性骨龄提前病人(20男,6.7±2.2岁;35女,6.4±2.0岁)。追踪中评价:BA、身高、体重、青春期过程和成年身高预测。达到的成年身高与预测的成年身高比较。
结果:追踪期间,BA-SDS显著下降(p<0.001),身高SDS也显著下降(p= 0.006),体重SDS无变化,青春期开始、持续时间和生长在正常范围之内。达到的成年身高与靶身高无显著性差异(男: 172 +/- 6.7cm与 171 +/- 6.1cm; 女 160.5 +/- 6.5cm与 159.0 +/- 6.8cm)。使用B-P发育加速表预测的成年身高是准确的。
结论:特发性BA提前的骨龄进展(骨龄SDS下降)与内分泌疾病的BA提前不同,确认了成年身高的预测和成年身高未受影响。这说明,需要最小的临床监测,通常不需治疗。
Horm Res Paediatr 2011;75:49–55
缩写词:AMH,抗苗勒激素;AUC:曲线下面积;CDP:体质性青春期延迟,CPHD:联合垂体激素缺乏;hCG:人绒毛膜促性腺激素;HH:低促性腺激素性腺功能减退;hMG:人更年期促性腺激素;IHH:单纯性HH;INHB:抑制素B;ROC:接受者操作特征;T:睾酮。
男孩青春期延迟是转诊至儿科内分泌的最常见原因之一,14岁年龄的发生率约2%,0.4%的1年后仍然为青春期前。鉴别诊断在于是体质性青春期延迟(constitutional delay of puberty,CDP)还是单纯性低促性腺激素性腺功能减退(isolated hypogonadotropic hypogonadism,IHH),估价男性的发生率在0.1%~0.25%,单基因或二基因病因解释了约10%~30%。在联合垂体激素缺乏症中也观察到了先天性低促性腺激素性腺功能减退(hypogonadotropic hypogonadism, HH)。但是,GH和TSH缺乏通常在儿童期诊断,在这些受试者的HH发生率还不完全了解,报告的数值在33%~97%。
在青春期延迟男孩,医生的任务是鉴别出促性腺激素性腺系统的缺陷。当为部分HH时特别复杂,因为这时青春期刚开始而未完成。但是推迟诊断可能损害受累者良好的心理状态、骨的矿化和生育力。特别是,甚至在存在Kallmann综合症的嗅觉缺失的情况下,为了得到正确的诊断许多病人要等待数年。
CDP和HH男孩有类似的激素特征,两种疾病的基线血清睾酮和促性腺激素浓度出现重叠。因此,曾经提出各种生理性和刺激性试验,例如,对各种刺激药物的LH取样、促乳素反应,对GnRH或超活性GnRH激动剂的促性腺激素反应,对人绒毛膜促性腺激素(hCG)的睾酮反应,以及每天尿FSH和LH排泄。这些试验不仅是有损伤的、费时的和昂贵的,而且也不能够以100%的敏感性和特异性区分两种疾病,在理论上,只有青春期完成的证实能够区分CDP和HH。
测量塞尔托利细胞生成的抑制素B(inhibin B, INHB)和抗-苗勒激素(anti-Mullerian hormone, AMH)循环水平的进展可能提供区分CDP和HH的简单方法,因为青春期前可检测这两种激素浓度,并且在青春期出现显著变化。INHB和AMH是糖蛋白,属于TGF-β家族。因INHB以其抑制FSH生成的能力而命名,出生后不久循环INHB出现高峰,然后下降,保持低水平但可测量到,青春期时先是由于FSH刺激,而后作为FSH调节和精子生成过程的结果,其水平再次升高。AMH因引起早期男性分化过程中缪勒管小消退而命名,其循环水平也在出生后达到高峰,然后在儿童期非常缓慢地下降,在青春期由于T水平增加而下调的结果,AMH循环水平急剧下降。
我们研究了82名14-18岁的青春期延迟男孩。16名IHH,15名为CPHD中的先天性HH,51名追踪证实的CDP。使用接受者操作特征(ROC)曲线,根据睾丸体积分析基线INHB、AMH、T、FSH和LH,将IHH、CPHD中先天性HH与CDP相区分的能力。
病人与方法
病人
我们研究了82名在14和18岁之间诊断的青春期延迟男孩。1998年1月至2007年1月巴黎Angers大学医院文森特-保罗医院儿科内分泌科对这些男孩进行了追踪。在诊断青春期延迟时以及在追踪完成时,测量这些儿童的睾丸体积。该研究得到了大学伦理委员会的批准。在研究期间,31名受试者未出现完全的自发青春期发育(HH组)。16名受试者有IHH,10名嗅觉缺失(Kallmann综合症,其中两名有KAL1突变,两名为CHD7突变的CHARGE综合症),6名无嗅觉缺失(单纯促性腺激素缺乏)。这些受试者中,6名有隐睾症(4名为双侧),在儿童期都以手术治疗痊愈。在外生殖器发育为I期(使用睾丸模型测量,睾丸体积<3ml,n=9)或骨龄大于13岁的外生殖器II期(睾丸体积3~6ml,n7),基线LH和FSH数值在青春期前范围,嗅觉缺失(n=10)或对hCG刺激试验的T值反应低于8.7nmol/l(n=6)(在第1,3,5,7,9和11天肌肉注射1500IU的hCG,第12天测量T)为疑似先天性HH诊断。以前曾证明,这个界值点对于HH的诊断至少有75%的敏感性和95%的特异性。这些男孩开始激素替代治疗(6名病人用T庚酸盐:每3周由50~100逐渐增加到250mg;10名病人使用hCG-人更年期促性腺激素hMG:hCG 1500 IU,每周1~3次,和75 IU hMG每周3次),使用的激素由医生、病人及其父母决定。在阴茎和阴毛完成生长并达到成年身高后,通过是否需要再替代治疗2或3年的重新评价来最终确定IHH诊断。在中断T替代治疗4至6个月之后,所有受试者的T水平不足3nmol/l,因此表明,必须继续治疗以保持性征和成年T水平。
15名受试者已知垂体激素缺乏,包括所有15名GH缺乏,13名TSH缺乏,8名促肾上腺皮质激素缺乏。垂体磁共振成像显示11名受试者垂体柄发育不全,两名视神经发育不全,1名垂体发育不全,1名垂体正常。这15名受试者中,5名有隐睾症,两名双侧(在儿童期手术治疗痊愈)。在具有CPHD背景下,当外生殖器为I期(n=7)或骨龄13岁以上而为II期(n=8),基线LH和FSH在青春期前状态时,为疑似先天性HH诊断。这些男孩已开始激素替代治疗(13名以庚酸睾酮,2名以hCG-hMG治疗)。使用与IHH组相同的标准,重新评价是否需要在替代治疗2或3年,结果表明必须替代治疗,以保持性征和成年T水平。
选择51名青春期延迟受试者作为对照组,选择标准:1)青春期延迟转诊年龄、睾丸体积、青春期发育分期:I期(睾丸体积<3ml,n=23)或II期(睾丸体积3~6ml,n=28),阴毛I期,均与HH组相似;2)都追踪到完全的青春期发育(Tanner外生殖器 5期)。在42名受试者证实了青春期延迟家族史,而每名受试者及其家族都无小阴茎、隐睾症、不育或嗅觉缺乏病史。一旦确定完全的青春期发育,最终确诊为CDP。这些男孩组成了青春期延迟转诊男孩的亚组。在转诊时有高度提示CDP临床特征的男孩(睾丸体积>6ml,阴毛II期,或最近生长加速)、没有追踪到完全青春期发育的男孩、以及缺少临床和激素数据的男孩不包括在对照组中。
激素测定
INHB以固相夹心测定方法测量。在INHB测定中,抑制素B有1%的交叉反应。在39pg/ml水平上,批间和批内变异系数分别为6.8%和21.5%;在112pg/nl水平上分别为5.7%和12%。测定灵敏度为6pg/ml。当数值小于6时,设定为5pg/ml。14~18岁男孩的正常范围在125~330pg/ml,抑制素B使用以前报告过的固相夹心测定方法,与TGF-β等蛋白无交叉反应。在107pmol/l水平上,批内和批间变异系数分别为2.3%和3.1%,在557pmol/l水平上,分别为1.4%和2.5%。14~18岁男孩的参考值范围在20~365pmol/l。使用RIA测量T,在0.81nmol/l水平上,批内和批间变异系数分别6.8%和11.5%,在1.6nmol/l水平上,分别为5.9%和8.2%,测定方法的灵敏度为0.046 nmol/l,测定准确度与本研究室质谱仪无差异,回归曲线为:Y(RIA)= 1.0×MS + 0.0049。14~18岁男孩参考值范围在4.2~24.3nmol/l。FSH和LH使用时间分辨荧光免疫测定方法。在FSH测定中,在3.1 IU/l水平上,批内和批间变异系数分别为1.2%和3.9%,在16.6 IU/l水平上,分别为1.5%和2.8%;在LH测定中,在0.3 IU/l水平上,批内和批间变异系数分别为1.4%和2.6%,在6.9IU/l水平上,分别为1.7%和2%。二者测定的灵敏度为0.01 IU/l。14~18岁男孩的参考值分别为0.6至4.8和0.9至2.0 IU/l。
统计学分析
所有数据以中位数和分位数表示(25th和75th百分位数)。使用Kruskal-Wallis检验做组间定量变量比较,定性变量使用χ2检验。睾丸体积和生物学变量之间的关系使用Spearman相关系数确定。使用ROC曲线描述和确定基线INHB, AMH, T, FSH和LH的真、假阳性率的平衡。每种试验的ROC曲线下面积以平均数和95%置信区间表示。显著性定义为P <0.05。我们也评价了基线激素水平每种可能的联合,以及睾丸与垂体激素水平每种可能的比例的诊断效能。所有分析为双尾,使用SPSS 16统计学软件包完成。
结果
受试者的基线特征(表1和附录表1)
男孩的中位数年龄为15.4岁((25th、75th百分位数: 15.0、16.0岁),睾丸体积中位数为2.5ml((25th、75th百分位数: 2.0、3.0ml),IHH、CPHD组中HH与CDP之间无显著性差异(表1)。但3组间的T, INHB, AMH, FSH和LH浓度存在显著性差异(所有比较,P<0.05)。1名隐睾症男孩的激素数值与其它亚组相似。
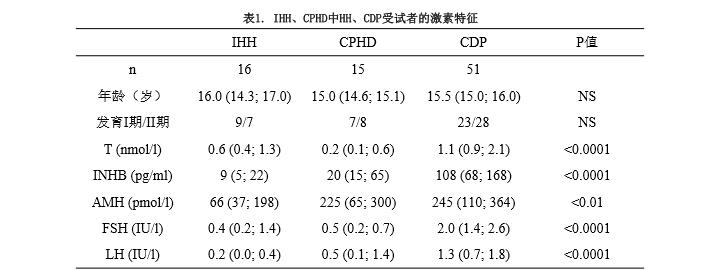
在IHH、CPHD、CDP组间,外生殖器分期I受试者的T、INHB、AMH、FSH和LH浓度有显著性差异(所有比较,P<0.01)(图1)。
在IHH、CPHD、CDP组间,外生殖器分期II受试者的T、INHB、FSH和LH浓度有显著性差异(所有比较,P<0.05),但AMH浓度无显著性差异(图1)。
虽然IHH和CPHD组中外生殖器I期受试者的T、INHB、AMH、FSH和LH同样都低,但II期受试者的可变性较大,因而提示了不同程度的性腺机能减退,以及睾丸对FSH和LH有不同程度的反应(图1)。
图1. 根据不同外生殖器分期的
INHB(左上图)、AMH(左中图)、T(左下图)、FSH(右上图)、LH(右下图)中位数及分位数范围。
HH和CDP受试者与睾丸体积的相关
在HH受试者,睾丸体积与INHB(P < 0.001)、AMH(P < 0.01)、FSH(P <0.05)和LH(P<0.05)正相关,但与睾酮无相关。在CDP受试者睾丸体积与INHB(P <0.01)、T(P <0.01)、LH(P<0.05)正相关,与AMH负相关(P < 0.05),但与FSH无相关。
激素及激素联合的ROC曲线
为研究基线INHB,AMH,T, LH,和FSH诊断HH的效能,依据受试者外生殖器分期构建了几条ROC曲线(图2),仅列出了敏感性和特异性相同或大于80%的不同界值点。此外,也指出了与单一激素诊断判别效能类似或更好的激素联合和比例。
INBH鉴别外生殖器I期受试者IHH与CDP的ROC曲线下面积(AUC)最大,然后是AMH。INHB浓度≤35pg/ml时,诊断HH的阳性率为100%,而假阴性率为0%。在AMH≤110pmol/l时,诊断IHH的的真阳性率为83%,而假阴性率为0%。其它单一激素界值点的灵敏性和特异性均低于80%。INHB与LH联合(界值点分别为35pg/ml和0.5mIU/l)、AMH与LH联合(界值点分别为150pmol/l和0.5mIU/l),鉴别外生殖器I期的IHH和CDP,也达到了100%的灵敏性和特异性。其它激素联合或比例都不能达到类似的诊断效能。
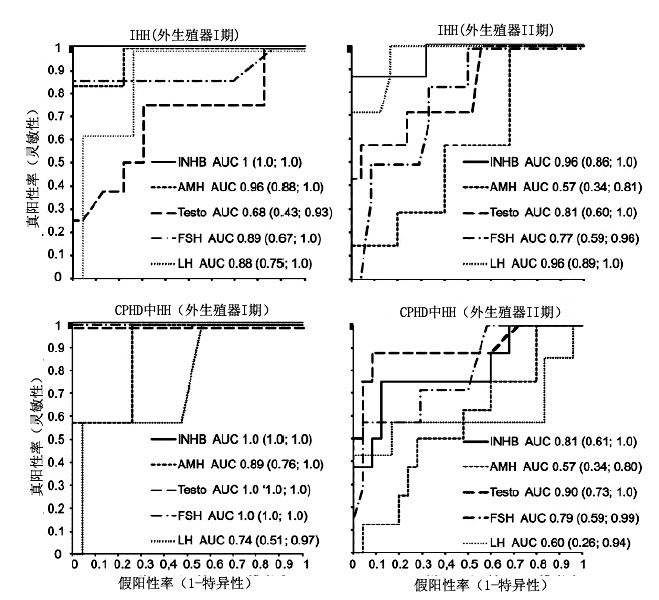
图2. 82名青春期延迟男孩基线INHB, AMH, T, FSH, LH的ROC曲线.
AUC:ROC曲线下面积及95%置信区间。左上图,睾丸体积<3mlde IHH; 右上图,睾丸体积3~6ml的IHH; 左下图,CPHD中睾丸体积<3ml的HH; 右下图,CPHD中睾丸体积3~6ml的HH。
INBH鉴别外生殖器II期受试者IHH与CDP的ROC曲线下面积(AUC)最大,然后是LH。INHB浓度≤65pg/ml时,诊断IHH的真阳性率为86%,而假阴性率为8%。LH浓度≤0.8mIU/l时,诊断IHH的真阳性率86%,而假阴性率为17%。其它单一激素所有界值点的灵敏性和特异性均低于80%,其它激素联合或比例的诊断效能都低于INHB。
当研究所有IHH组(无论生殖器分期如何)时,INHB的判别效能下降,INHB 浓度≤35pg/ml诊断IHH的真阳性率为93%,而假阴性率为0%。其它联合或比例都不如INHB。
在鉴别外生殖器I期受试者的CPHD组内HH与CDP时,INHB、T、FSH的ROC曲线下面积(AUC)最大(图2)。INHB≤35 pg/ml、T=0.3IU/l、FSH=0.7IU/l浓度时,诊断HH的真阳性率为100%,而假阴性率为0%。其它激素的所有价值点的灵敏性和特异性均低于80%,其它激素联合和比例均达不到类似的效能。
在鉴别外生殖器II期受试者的CPHD组内HH与CDP时,T的ROC曲线下面积(AUC)最大(图2)。在T浓度≤0.87nmol/l时,诊断HH的真阳性率为88%,而假阴性率为12%。INHB浓度≤65pg/ml时,诊断HH的真阳性率为80%,而假阴性率为12%。其它激素所有界值点的灵敏性和特异性均低于80%,激素联合与比例均达不到类似的效能。
对于所有CPHD组内HH受试者,INHB和T的判别效能下降,在T浓度≤0.87nmol/l时,诊断HH的真阳性率为93%,而假阴性率为19%;在INHB浓度≤65pg/ml时,诊断HH的真阳性率为87%,而假阴性率为20%。激素联合和比例均达不到类似的效能。
讨论
本研究证明基线INHB水平是鉴别青春期男孩IHH与CDP的有力诊断工具,真阳性率86%~100%,假阴性率0~8%;对CPHD中的HH,真阳性率和假阴性率分别为80%~100%和0%~12%。在睾丸体积≤3ml(可能说明了完全的促性腺激素缺乏)的HH受试者更精确,一次测定的基线INHB≤35pg/ml提供了100%的敏感性和特异性。其它基线测量指标(AMH、T、FHS和LH)都没有类似的鉴别能力。
在青春期前男孩和成年男子,FSH刺激INHB的生成。在HH受试者注射重组FSH有力刺激了婴儿和成年人的INHB的分泌,而GnRH处理抑制FSH,继之以INHB和FSH水平的下降。同样,FSH刺激通路的构成性受体后激活导致青春期前男孩过早的INHB过多分泌,而FSH受体基因失活突变男性受试者INHB水平非常低。与这些数据一致,我们的研究证实,血清INHB浓度是FSH生成水平的可靠指示物,而基线血清FSH浓度并不能以足够的敏感性和特异性鉴别HH和CDP。
我们的研究结果与以前的研究不同。以前的研究提出,只能通过GnRH激动剂或hCG处理的动态测试,能以80%~100%的敏感性和特异性区分CDP和IHH。根据我们的结果,一次测量INHB就能够提供诊断IHH受试者的类似效果,而费用低得多。与这些结果相一致,正常和HH受试者的基线INHB与对hCG的T反应高度相关。与我们全部IHH组基线INHB的93%敏感性和100特异性相比,在一项最近的研究中,19天的hCG刺激提供了诊断IHH的92%敏感性和95%的特异性。但是,联合进行GnRH刺激试验和19天的hCG处理,对这两种疾病的鉴别诊断达到了100%的敏感性和特异性,而我们仅在显著促性腺激素缺乏(睾丸体积<3ml)的IHH受试者达到了同样的结果。在我们的IHH受试者中,在促性腺激素缺乏不太严重(睾丸体积3~6ml)时,敏感性和特异性分别下降到90%和92%。这种疾病可能更加复杂,因为已经发表的报告表明,正常青春期发育后的成年病人出现IHH、IHH在成年期逆转、以及尽管携带FGFR1突变而表现部分至正常的青春期发育和异常的INHB水平。总之,这就提示了IHH宽大范围的临床与生物学表现谱,可能阻碍了任何激素指标的区别能力。
但是,根据临床的观点,14岁至18岁之间表现出明显青春期延迟的青少年被怀疑有完全或几乎完全的HH,其中的大部分可使用一次基线INHB测量而充分诊断。
因为在睾丸变化情况下激素水平较低,所以hCG试验以及INHB和AMH测量区分IHH和CDP的价值可能因性腺损害而具有局限性。特别是,有无隐睾症的受试者所有激素值相似,可能由睾丸损害引起。IHH的性腺损害问题是困难的,正如最近Sykiotis et al.的研究所证明,他们通过长期的GnRH处理估价性腺损害,在90名IHH男性中的23名病人发现了这样的损害,与隐睾症并无明显关联。在我们的研究中,鉴于INHB和AMH水平不能鉴别出无隐睾症的HH受试者,我们认为促性腺激素缺陷超过了潜在的性腺损害,因此FSH和LH不能增长。
IHH受试者的AMH水平也显著低于睾丸体积<3ml的CDP受试者,与INHB的100%相比,AMH水平≤110pmol/L的数值有83%的真阳性率。AMH较INHB有较低的效果可能是AMH对FSH活性的依赖性较低。在男性,AMH仅由塞尔托利细胞生成,已经证明通过非典型的通路对FSH敏感。在男性婴儿,AMH水平显著相加,伴随以FSH水平的增加,但此后,尽管6个月龄时FSH水平下降,而AMH浓度保持稳定。出生后AMH分泌的激活的确与出生后塞尔托利细胞增殖的波动相一致。另一方面,众所周知,青春期开始后T下调AMH的分泌。在我们研究中的CDP受试者,正是由于这种可能的下调作用,睾丸体积与T和INHB正相关,与AMH负相关。总之,循环AMH水平依赖于塞尔托利细胞池、FSH刺激和T的下调。在我们的研究中,深度IHH受试者较低的AMH数值可能反映了较小的塞尔托利细胞池。因为几种调节因素相互作用的结果,各亚组之间的AMH水平存在重叠,可能说明了相对于INHB来说,AMH有较低的诊断有效性。
IHH受试者的T、FSH、LH数值显著低于CDP。特别是,T测定的较低敏感性使得我们检测IHH和CDP之间的激素差异,这在以前的大部分研究中所没有的。基线TROC曲线的AUC为0.68~0.81,而在Segal et al.的研究中为0.63。但是基线T,以及LH和FSH的敏感性和特异性仍然低于80%。这一点和以前许多得出基线T、LH、和FSH不能区分IHH和CDP结论的研究一致。
在CPHD中的HH受试者,INHB和T表现出80~100%的敏感性和80~100%的特异性,这低于对IHH的相应数值。对于睾丸体积<3ml的受试者INHB和T有100%的敏感性和特异性,而对于睾丸体积3~6ml时敏感性和特异性下降到90%左右。但由实用观点来看,这些受试者在青春期前,由于联合垂体激素缺乏,主要是因GH缺乏而矮身高,已经得到医学关注。在这一类病人中,HH的概率是单纯青春期延迟病人的20~50倍,因此,为诊断HH的高度敏感性,以特异性相对损失为代价是值得的。基线INHB和T正确诊断80~90%的HH受试者,根据尽早治疗诱发生育力的观点来看,这是适宜的。
在青春期适时诊断HH对于生育力的诱发具有重要意义。曾经证明,以hCG-重组FSH早(青春期或成年初期)治疗能够比晚(成年期)治疗更好地达到精子生成。而且,在HH成年人生育力预测因素的研究中,以前以促性腺激素治疗独立预测了更快的诱发精子生成和无辅助的妊娠,而以前应用雄性激素则有消极的影响。
我们的研究结论为,在外生殖器I期受试者,基线INHB极好地鉴别了HH与CDP,也较好地鉴别了外生殖器II期受试者,可能是动态试验的简单替代方法。