儿科库欣氏疾病诊断时的骨龄和影响骨成熟的因素
Shrikrishna V. Acharya • Raju A. Gopal • Anurag Lila • Padma S. Menon
Tushar R. Bandgar •Nalini S. Shah
Department of Endocrinology, Seth G S Medical College and KEM Hospital,
Mumbai 400 012, Maharashtra, India Medical College
and KEM Hospital, Mumbai 400 012, Maharashtra, India
摘要:儿科库欣氏疾病(Cushing’s disease,CD)通常与生长延迟相关联,但发表的诊断时骨成熟度的数据很少。我们分析了贡献于亚洲印度儿科CD病人骨成熟度和成年身高的因素。我们对48名病人(29男,19女)进行了回顾性分析,诊断时平均年龄14.84岁(9~19岁)。使用G-P法确定骨龄。骨龄延迟为生活年龄与骨龄差值,与临床和生化变量比较。其中35名(73%)病人骨龄延迟(平均延迟1.6岁,范围0.5~5岁),与身高SDS负相关(r = -0.594, P<0.001),与诊断时的生活年龄正相关(r = 0.247, P<0.05),与诊断前的症状持续时间、基础皮质醇、午夜皮质醇、ACTH或低剂量地塞米松抑制皮质醇的抑制百分数无相关。我们证明诊断前病史持续时间与最终身高时的身高SDS无相关。平均最终身高SDS为-1.84。我们发现大部分CD儿童骨龄延迟,并与诊断时的生活年龄和身高SDS显著相关。及早诊断可能减少骨成熟度延迟,因而能够得到最佳的赶上生长。
Pituitary (2010) 13:355–360
关键词:库欣氏综合症 骨龄 最终身高
前言
儿科库欣氏综合症(Cushing’s syndrome, CS)是一种少见的循环糖皮质激素浓度过高的疾病,75-85%的儿科CS由库欣氏疾病(CD)所致,由分泌促肾上腺皮质激素(ACTH)的垂体促肾上腺皮质激素细胞腺瘤所引起。儿科CD的一种主要并发症是生长延迟。大量数据证实CD儿童骨密度下降,但对于诊断时骨成熟度的数据有限。以前的研究报告CD儿童很可能出现与生活年龄(CA)相比的正常或延迟的骨龄。
儿科CD中,肾上腺皮质醇增多症和肾上腺雄性激素增加的反向作用对于骨成熟可能有不同的效应。损害骨成熟的因素降低了生长激素的分泌,而且糖皮质激素对生长板有直接影响。也有证据表明,抑制下丘脑-垂体-性腺轴,导致青春期延迟,进而延迟骨成熟。相反,由于肾上腺雄性激素过多也可能加速线性生长并使骨成熟提前。
我们报告过去20多年中诊断和治疗的CD儿童青少年生长学数据,分析诊断时的骨龄和可能影响骨成熟及成年身高的因素。
病人和方法
病人
48名病人(29年,19女,平均年龄14.84岁,9~19岁),1988年和2008年期间在印度塞斯医学院及Mumbai医院诊断为CD的病人。
方法
CD的诊断
CD的诊断根据生化标准:皮质醇分泌过多,午夜皮质醇水平生升高>1.8ug/dl(说明无昼夜节律),低剂量地塞米松抑制试验(low-dose dexamethasone suppression test, LDDST)不能抑制皮质醇到<1.8ug/dl,基础ACTH>5pg/ml。
CD的治疗
所有48例病人均完成了经蝶手术,然后有11名病人又经过垂体放射治疗,在7名病人经过重复性经蝶手术治疗,四名病人双侧肾上腺切除。
生长学
使用标准的人体测量学方法进行人体测量。身高测量精确到0.1cm,并根据印度1992年参考标准,以标准差分值表示。使用Tanner标准评价青春期。根据临床检查诊断假青春期,表现为睾丸大小与阴毛发育分期不一致。
骨龄
根据无利手腕X线片,使用G-P方法测定每名儿童的骨龄(BA),虽然这种方法在印度使用很多年了,但仍然未确认。骨龄延迟的计算为生活年龄与骨龄的差值,并与临床和生化变量比较。
激素测定
以固相、双位点连续化学发光方法测量ACTH,批间变异系数(CV)为5.1–9.4%, 批内变异系数为3.1–9.6%,测量的灵敏度为0.50pg/ml。皮质醇测定采用固相、竞争化学发光酶免疫法,测定的灵敏度为0.2ug/dl,批内和批间变异系数分别为6.9%和7.3%。
统计学分析
使用SPSS14.0版分析数据。使用非参数Spearman秩相关分析BA延迟与临床和生化变量之间的关系。差异P<0.05为具显著性。
结果
诊断时的临床特征
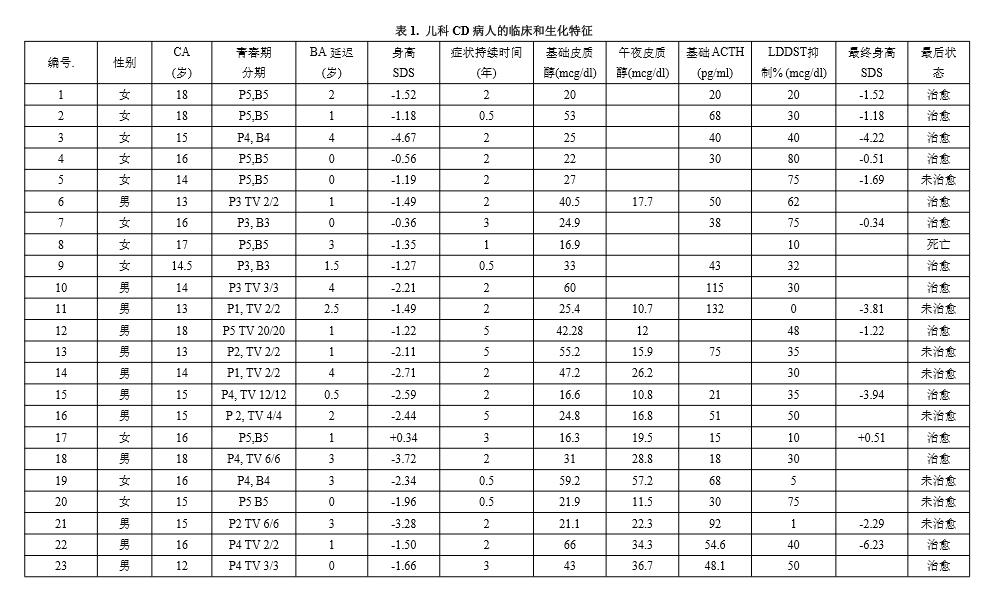
诊断前的症状持续时间在6个月至5年,平均身高SDS为-1.9(范围+0.34~-6.67)。19名病人(40%)的身高SDS<-2.0,28名病人(58%)身高SDS<-1.5。
女性病人就诊时平均年龄15.13±1.90岁,身高SDS-1.49,平均骨龄延迟1.28±1.16岁。男性病人身高SDS-2.18,骨龄延迟1.79±1.41岁。
46名病人出现第二性征,2名为青春期前。31名病人为真实的青春期发育,以Tanner乳房发育等级>2或睾丸体积>4ml确定,15名病人为假青春期。非真实青春期病人的身高SDS为-1.97(范围-3.11至-1.38),青春期前的病人为-1.87(范围(-6.67至+0.34),见表1。

骨龄
35名病人的骨龄小于生活年龄,即骨龄延迟,总平均骨龄延迟1.6岁(范围0~5岁)。男性病人骨龄延迟(平均1.79岁)显著大于女性(平均1.28岁)。
骨龄延迟与身高SDS负相关(r = -0.594, P<0.001),也与诊断时的生活年龄相关(r = + 0.247, P<0.05),但与症状持续时间无相关。骨龄与其它生化变量,例如基础皮质醇、午夜皮质醇、基础ACTH、LDDST抑制的百分数无相关(表1)。
最终身高时的生长参数
48名病人中,20名病人有最终身高(FH)。由诊断至最终身高之间平均时间间隔为4.1年(0~10.7年)。这段前的病史持续时间与最终身高时的生长参数无相关。平均最终身高SDS为-1.84,最终身高时9名病人身高SDS<-2.0。
讨论
我们发现大部分CD儿童和青少年就诊时都有骨龄延迟的表现。就我们所知,这是最早的亚洲印度CD儿童的数据。美国一项国家卫生研究所的研究检查了50名CD儿童,未发现骨龄延迟,在他们的研究中主要是青少年,在平均14岁时诊断。我们的病人中也大都在青春期,平均14岁时诊断,其余为青春期前或假青春期。这就说明了两项研究中骨龄的差异的原因。在另外一项Peters et al.的研究中,在均12岁时诊断,骨龄显著延迟。
在本研究中,诊断时的身高SDS和诊断测定时的生活年龄都与骨龄延迟相关,可能反映了长期暴露于高皮质醇水平的累积效应。但是,症状持续时间与骨龄延迟无相关。CD通常是在不知不觉之间开始,因而家庭和治疗医生难以确定疾病症状开始时间。已有发表的皮质醇增多症诊断前症状持续时间的数据,我们病人的平均持续时间为2.04年,与NIH研究组的平均3.0年以及Peters et al.的平均2.5年相似。高皮质醇血症的暴露时间似乎比一次测量的皮质醇水平更重要,因为全组的午夜皮质醇水平、基础皮质醇或基础ACTH与骨龄延迟无相关。
可能许多因素贡献于长期高皮质醇血症与骨龄延迟之间的关系。已经证明CD儿童有GH缺乏,虽然IGF-I正常,但疾病期间自发的和刺激的GH减少。糖皮质激素抑制大鼠软骨细胞中GH引起的IGF-I分泌及其作用。也可能通过下调软骨细胞中GH结合蛋白和GH受体mRNA,增加循环IGF-I抑制因子而出现对GH作用的抵抗。糖皮质激素可能也下调血管内皮生长因子,导致血管正常侵入生长板的破坏,扰乱软骨内骨化和生长。高皮质醇水平可能也通过干扰分化与复制,减少成熟的成骨细胞数量与功能。高水平的皮质醇也引起成骨细胞和骨细胞的凋亡。
与这些作用相反,CD病人ACTH的过多分泌可能引起肾上腺雄性激素分泌的增加,雄烯二酮和双氢表雄酮硫酸盐(DHEAS)浓度也升高,特别是在男性化异常的病人。这些肾上腺雄性激素可能加速线性生长和骨成熟,例如男性化肾上腺瘤病人。高水平的循环肾上腺雄性激素也可能通过外周p450芳香化酶作用转换为雌性激素,对骨成熟和骺闭合发挥重要作用。这些可能是某些病人骨龄正常的一个原因。
本研究有一些局限性。我们未能测量更好反应组织连续皮质醇暴露的24小时尿皮质醇水平。少数病人无成年身高。我们未能够测量DHEAS水平或其它雄性激素生成增加的指标。
总之,CD儿童骨龄延迟很可能是长期皮质醇过多症引起。骨龄延迟程度与诊断时的生活年龄和身高相关。身高SDS与征兆持续时间无相关。重要的是要尽早诊断儿科CD,防止骨成熟度严重延迟,因而有助于最适宜的赶上生长。

