特发性矮身高:遗传影响GH与IGF-I治疗之间的选择吗?
Martin O Savage, Cecilia Camacho-Hübner, Alessia David, Louise A Metherell, Vivian Hwa1, Ron G Rosenfeld2 and Adrian J L Clark
Endocrinology Centre, William Harvey Research Institute, Queen Mary, University of London, London, EC1M 6BQ UK, 1 Department of Pediatrics, Oregon Health and Sciences University, Portland, Oregon, 97239-3098 USA and 2 Lucile Packard Foundation for Children’s Health, Palo Alto, California, 94304 USA
该文发表在2007年3月16~18日葡萄牙里斯本举办的“生长与代谢生物学进化”专题研讨会“伊普森”专辑中。伊普森支持了专辑的发表。
摘要
背景:特发性矮身高(Idiopathic short stature,ISS)包括了一系列的疾病,某些由GH-IGF-I轴的缺陷所引起。在美国ISS是被批准的GH治疗的适应症,不久也很可能得到欧洲的批准。单基因缺陷分析为了解生长调节生理学做出了许多的贡献。这种类型的研究有助于预测GH或IGF-I治疗的生长反应吗?
方法:综述选择GH或IGF-I治疗ISS的基本原理。许多ISS病人有低水平的IGF-I,但对于短期GH处理的反应,大部分病人能够生成IGF-I。似乎存在某些GH抵抗。综述几类GHIS和ISS病人的突变分析。
结果:低IGF-I水平提示了未知的GH缺乏或GH抵抗。在典型GHIS病人,IGFBP-3水平与身高SDS正相关。突变与表型之间无相关,携带同一突变的病人表型有宽大的可变性。在<5%的ISS病人存在杂合子GH受体突变,这些突变对生长缺陷的作用存在疑问。已经证明扰乱生长的显性负突变是例外。
结论:单基因缺陷分析不能敏感地预测表型,并不能预测GH或IGF-I治疗的生长反应。内分泌异常与表型有较清楚的相关,因此可更好地指导治疗反应。Eur J Endocrinol, 2007, 157(suppl1):33-37.
前言
矮身高儿童的诊断是一个难题,临床表型、内分泌特征和遗传因素都作用于特定类型的诊断。分子遗传学的发展改变了内分泌学诊断的许多方面,可能使通过病史、临床评价和适当深入分析的传统临床过程发生“短路”。然而,不应鼓励不考虑基本步骤而对病人进行基因型分析,因为只有在了解了内分泌机制受到干扰的程度,并因此归因于遗传缺陷的情况下,才能对遗传结果进行解释。
特发性矮身高(idiopathic short stature,ISS)术语描述了无特定病因的宽大范围的矮身高儿童。在ISS病人中,已经排除了特定病因,例如,生长激素缺乏、特纳综合征、因出生体重矮身高、小于孕龄儿、畸形综合征和慢性儿科疾病。排除这些病因后,还有很多种选择的矮身高儿童,可能包括了遗传或家族性矮身高、体质性生长延迟、以及相对于父母靶身高异常矮的儿童,这些儿童可能存在未知的内分泌缺陷。
由治疗的观点出发,后一类儿童是重要的。如果这一类儿童存在未知的GH缺乏,那么他们会对GH治疗出现良好的反应,然而如果是GH抵抗,就可能是重组人胰岛素样生长因子-I(rhIGF-I)治疗的候选者。在本短评中,将讨论遗传学分析是否能够帮助预测适当的治疗模式的问题。
ISS的内分泌特征
通过定义,ISS儿童有正常的GH分泌,GH的分泌几乎都是使用药理学GH刺激试验来分析。在矮身高的临床诊断中,很少包括自发GH分泌的评价。GH神经内分泌机能障碍的实体仍然存在争论;然而,大部分临床医生已经观察到,药物刺激试验后GH峰正常的矮身高儿童生长缓慢而且对GH治疗反应良好。我们研究组在ISS病人,研究了自发GH分泌,发现总的平均GH分泌稍下降,与66名正常身高对照组比较,以SDS表示的GH分泌为:基础GH -0.84(–0.84–0.93), GH峰与0相比的高度–0.36 (–1.26–1.51,二者P<0.05);总GH分泌–0.76 (–1.22–0.42),基线之上的总GH分泌–0.67 (–1.21–0.94,二者P<0.01)。
ISS儿童有相对正常的GH结合蛋白水平(GHBP)。但是,某些被选择以GH治疗的病人有低浓度的GHBP,提示GH受体(GHR)功能的下降。这些病人有较低水平的IGF-I,而内源性GH分泌较高,提示了GH的部分不敏感性。ISS儿童的基础IGF-I水平通常处于低至正常低水平之间。但是,IGF-I的缺乏程度不如严重GH缺乏以及典型的或非典型的GHIS病人那样显著。
在对ISS儿童的某些IGF-I生成实验研究表明,IGF-I和IGF结合蛋白(IGFBP-3)生成下降,与某种程度的GH抵抗一致,但比纯合子GHR缺陷病人高许多。我们研究组在标准化的低剂量IGF-I生成实验中,证实了满意的IGF-I和IGFBP-3的生成,表明大部分ISS儿童能够对短期GH刺激产生反应。ISS病人的GH-IGF-I轴的异常得到了公认。
ISS的遗传研究
ISS病人与部分或非典型GH不敏感性(GHI)病人之间存在重叠。这种认识来自于欧洲GHI病人组群研究,其中某些病人没有典型的Laron综合征表现。事实上,某些病人有轻微矮身高和正常的面部外观,生化异常较小。
这里应当强调,在欧洲GHI系列中,GHR纯合子突变与临床表型之间无相关,这与以IGFBP-3 SDS表示的生物缺陷与身高SDS之间密切正相关的报告截然不同。
在1997年,Ayling et al.对无Laron综合征特征的矮身高家庭异常生长的遗传提出了新看法。儿童及其母亲有显性负效应的杂合突变,这种突变(IVS8as-1 GC)位于外显子8的剪接受点,导致外显子9的遗漏和缺失的GHR产物。突变GHR与野生型GHR形成二聚体,对正常蛋白发挥显性负效应。Iida报告的第二种突变(IVS9ds+1 GA)导致同样的结果。这两种病人都有阳性GHBP和正常的面部外观。
在引起外显子6和7之间插入假外显子突变的4名兄弟姐妹,我们报告了类似的表型,108 bp插入引起密码子206和207之间额外的36个氨基酸(图1)。我们预测,这将影响受体的二聚作用;但突变GHR的晶体结构模型表明未发生二聚作用区域的改变,细胞研究中发现了传递的缺陷。我们在最近的一项研究报告中,进一步发现了有这种突变的多名病人。但是,仍然缺乏基因型与表型的关系。
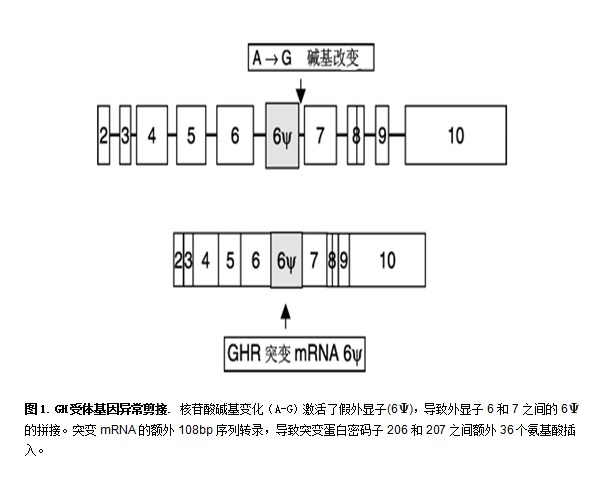
ISS的杂合子GHR突变
已经评价了GH分泌正常的ISS病人的GHR异常。虽然报告了60多种GHR分子学缺陷,但是大部分ISS病人有正常的GHR编码区域。
在1995年,Goddard et al.研究了一组提示,部分GHIS的ISS病人有低血清GHBP。4名病人有杂合子GHR突变。1名病人的复合杂合子(两种有害的突变,E44K 和R161C)能够解释病人的矮身高。其它3名病人,可能在细胞内区域存在第二种未被识别的引起ISS的突变,因为对这些病人未进行跨膜和细胞内区域测序。为此,Goddard研究组研究了100名全ISS谱的病人,结果发现3名杂合子细胞内突变携带者,1名外显子10内的杂合子突变(A478T)。同样,一项17名ISS病人的研究发现,1名病人外显子6有新杂合突变(V144I)而另一等位基因无突变的病人。另一项26名ISS病人的研究发现了1名以前曾经报告过的杂合子GHR突变(R161C)病人。最近的37名ISS病人的研究揭示了两种新的GHR突变(C94C, V144A),而在100名对照组则未发现。这些研究主要依赖了单链构象分析,而不是GHR基因的完全测序。总之,可以估价,最多5%的ISS病人有杂合子GHR突变,引起生长障碍中的作用尚不清楚(图2)。
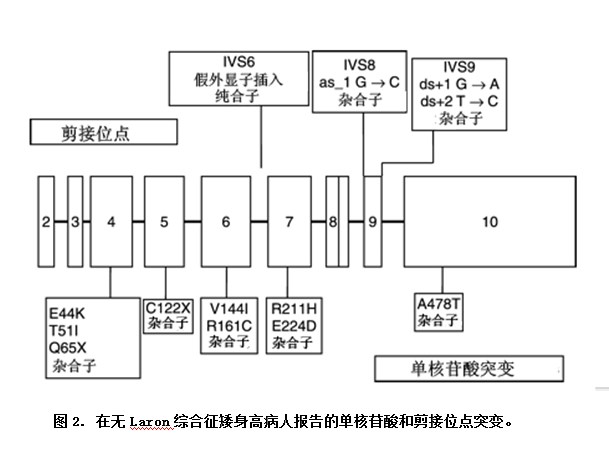
单核苷酸多态性与矮身高
在ISS病人也已经鉴别了GHR多态性,两种突变(C422F和P561T)与ISS有关,但尚未验证这些突变的功能。在野生型与C422F突变GHR之间无信号转导差异。在5%的正常人群发现有P561T变化,但与身高无关。
与矮身高有关的GH作用新遗传缺陷
GHR细胞内信号转导(STAT5b)缺陷
两项研究证明了ISS病人STAT蛋白缺乏GH引起的酪氨酸磷酸化,但是作者未能鉴别出这些病人的突变。只在最近,出现了第一篇GH信号转导级联缺陷的报告。Kofoed et al.报告了STAT5b基因外显子15的纯合子突变,并证明了突变的蛋白不能被GH所激活,因此不能激活基因的转录。这名儿童具有严重的GHI特征,同时具有与无功能性STAT5b相一致的免疫缺陷。
最近,Rosenfeld et al.仔细推敲并综述了目前所报告的7名不同病例,显然,遗传突变与生长表型相关,这种生长表型不如纯合子GHR突变所引起的Laron综合征那么严重,我们两病例的研究与此一致。尽管如此,生化特征证实了严重而明确的GHI。
酸性不稳定亚单位(ALS)缺陷
IGF-I是调节人类生长的依赖GH的效应蛋白,在循环系以IGF-I、IGFBP-3和ALS组成三元络合物。ALS敲除动物模型提出了在IGF-I系统中ALS作用的新看法,出生后3周可见生长不足,GH水平正常,而IGF-I和IGFBP-3显著下降。在2004年,Domene et al.报告了首例ALS突变失活病例。这种缺陷为1338位置上鸟嘌呤缺失,导致移码和过早终止密码子(1338delG, E35fsX120)的出现。但基础GH水平增加,IGF-I和IGFBP-3下降,ALS检测不到,对于GH刺激无反应。此后,又报告了几例ALS突变病例。相对隐秘的生长缺陷可由GHR上调刺激的生长板内局部保持IGF-I生成来解释(图3)。
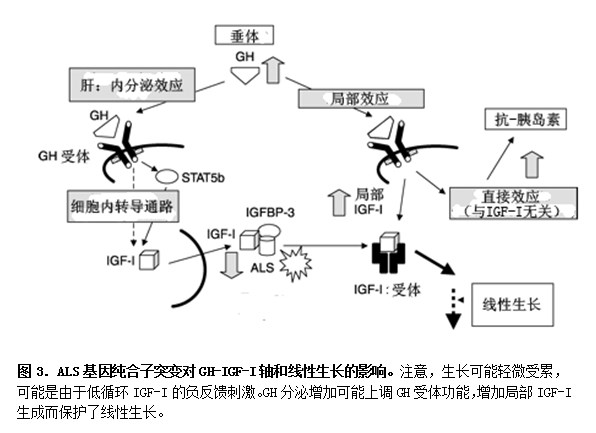
是GH还是IGF-I治疗ISS?
如上述所讨论,ISS由广泛选择的不同矮身高病因的病人所组成。某些儿童有一定程度的GH缺乏,对于GH替代治疗有良好的反应,而另一些病人有生长激素抵抗,更得益于IGF-I治疗。尚无对ISS儿童以IGF-I治疗经验的报告。
另一方面,现在以GH治疗ISS的报告很多。在2003年,FDA批准以GH治疗ISS病人,本评论不对非GH缺乏的矮身高病人以GH治疗的益处进行讨论,因为可以预期,在多种病人人群会存在有良好反应者和反应不好的病人。显然,这在一定程度是GH反应性或敏感性在起作用。治疗中循环IGF-I水平与反应程度相关。
结论
遗传学分析增加了对矮身高调查分析的范围。但是,特殊突变的性质不能预测特定的促进生长治疗的反应。在GH抵抗疾病领域中,基因型-表型关系较低,通过研究基础和刺激的IGF-I水平可以达到更好的生长预测。然而,在澄清生长缺陷病因中,特定单基因突变的鉴别非常重要,如同STAT5b和ALS突变所证实。与基因多态性不同的基因缺陷的鉴别有助于阐明生理学机制,但目前还达不到敏感预测最佳治疗选择或反应性。
【喜高科技】业内骨龄评价专家、专业骨龄研究科技机构及骨龄软件应用服务商!
热门文章推荐

